动态生成:认识误区及其调控策略 以化学课堂为例
动态生成:认识误区及其调控策略 以化学课堂为例
许璠 (江苏省海州高级中学,222023)
摘要:动态生成体现了课堂教学的丰富性、开放性、多变性和复杂性,激发了师生的创造性和智慧潜能,使课堂教学焕发出生命的活力。现实中,对动态生成存在着两大误区:或违背规律,刻意追求生成;或缺乏引领,盲目应对生成。面对动态生成,应适时予以恰当的回应:或顺水推舟,或将错就错,或求真创新,从而,让学生经历“再创造”,建立属于自己的认知结构。
关键词:动态生成认识误区调控策略
叶澜教授在《重建课堂教学过程观》一文中指出:“要把教学过程看作是师生为实现教学任务和目的,围绕教学内容,共同参与,通过对话、沟通和合作活动,产生交互影响,以动态生成的方式推进教学活动的过程。”传统课堂把“生成”看作一种意外的收获,新课程则把生成当成一种追求;如果说传统课堂把处理生成看作一种教学智慧,新课程则把生成当成彰显课堂生命力的常态要求。每一位教师都应该关注课堂动态生成的研究。
一、对动态生成的两大认识误区
(一)违背规律,刻意追求生成
有的教师心中缺少对学生能力的思考,不能准确把握学生的“最近发展区”,对生成的刻意追求,反而导致学生的思维陷入僵硬、困顿的状态。
比如,苏教版高中化学必修二的《乙醇》一课,证明乙醇的结构是重点。课堂上,教师先让学生动手将2个碳原子、6个氢原子、1个氧原子搭建成可能的分子模型作为探究的切入点,然后立刻让学生通过钠与乙醇的定量实验,结合数据分析确定乙醇的结构。由于这个分析缺少必要的预设(即根据钠与水、乙醇反应和钠能保存在煤油中的事实进行对比分析,来初步确定乙醇的分子结构),学生一时难以达到教师所要求的高度,教师期待的“生成”始终没有出现。
其实,站在学生的角度设想探究过程中可能遇到的障碍,预设好各种能帮助学生翻越障碍的“脚手架”,才能成就精彩的动态生成。比如,我在教学该课时,事先预设学生在解决乙醇分子结构时可能会无从着手,为学生搭建了这样一个“脚手架”——由于乙醇分子的可能结构只有两个,要证明乙醇属于何种结构,科学上通常有两种思想,即想办法证明是某个结构或排除某个结构——如此,从科学方法上加以引导,学生就有了思考的方法和方向。果然,课堂上,有学生很快用排除法解决了问题(金属钠保存在煤油中,可见钠并不能破坏碳氢键,因此它不可能是CH30CH3结构,那么就一定是CH3CHzOH结构)。又如,在证明钠与乙醇反应所产生的氢气中的氢原子到底源自何处时,学生一时束手无策,我便引导学生想办法寻找更可靠的实验依据,把学生的思维引向定量实验——测量氢气体积。这一新的问题资源成为了学生进一步探究的载体。借助这个“脚手架”,学生成功地探究出了乙醇的分子结构,更深切地体会到尊重实验事实的科学探究精神。
(二)缺乏引领,盲目应对生成
有的教师对课堂中出现的生成内容缺乏价值判断,不管有无必要都让学生探究一番。事实上,动态生成不是无中生有,教师作为教学的组织者和引导者,必须合理作出取舍,为学生的探究活动指引航向。
比如,教学Na2O2的性质时,教师首先让学生分组实验:先在盛有Na2O2的试管中加水,观察现象。再向其中加入酚酞,溶液先变红然后又褪色。对褪色的原因,学生提出如下几种可能:(1)生成02,使酚酞褪色。(2)反应放热,使酚酞分解。(3)Na2O2本身具有漂白性。在其后的探究活动中,又有学生提出:较浓的NaOH也能使酚酞褪色。教师指导学生再次通过实验求证该事实,接着,让学生继续探究不同浓度的NaOH与酚酞反应的现象并探究其规律——这个“轰轰烈烈”的探究直至下课也未能得出什么结果。事实上,该节课的重点在于让学生通过实验了解NNa2O2与水和CO2反应的性质,而该教师却因为学生的生成完全转移了“目标”。
对于课堂生成,如何适时地予以恰当的回应,需要我们不断探索和研究。像NaOH使酚酞褪色这个突发事件,教师应结合该节课的教学目标,让学生把这个现象作为课外兴趣小组的研究课题去研究,然后,把探究重点回归到“正途”上,才能使有限的课堂时间更加有效。
二、对动态生成的调控策略
课堂预设必不可少,预设的目标在实施过程中,需要开放地纳入直接经验、弹性灵活的成分以及始料未及的体验,也可根据需要改变预设目标,重新设置开放的、适应学生需要的教学流程。有了师生互动中的即兴创造,课堂教学才会成为一种艺术,才会充满生命的气息,才会出现没有预约的精彩。
(一)顺水推舟
教学“影响化学反应速率的因素”一节内容,应以微观分子间碰撞为起点,以生活中汽车加速、食物保存为背景,引导学生用理论来解释微观粒子碰撞对化学反应速率的影响。在学生会用有效碰撞和活化分子理论解释不可逆反应以后,再引导他们归纳总结规律。虽然这一节主要研究的是可逆反应,但教材中并未出现对可逆反应的影响的解释,考虑到课堂时间有限,我在课前预设这部分内容时决定先撇开可逆反应,把重点放在理解有效碰撞和运用活化分子理论解释不可逆反应。谁知,在运用活化分子理论解释了不可逆反应后,有一位学生怯怯地站起来说:“老师,此理论是否适用于可逆反应呢?”我犹豫着,正想说这个问题下节课再讨论,一个清脆的声音猛然响起:“老师,我知道。”我讶然,忙问:“你是怎么知道的?”“我从我哥的书上看到的。”看来回避不是办法,我便说:“那就请你来当老师,把你所知道的知识和同学们交流一下,好吗?”该生兴奋地介绍起来。此时,整个教室静悄悄的,其他学生都用羡慕的眼光看着他,尽管他说得不是那么完整、那么准确,但是他把同学们的注意力都集中过来,大家对新知识充满了渴求——在这样的状态下学习可逆反应,肯定事半功倍。其后,我顺势利导。带领学生一起探讨可逆反应。
(二)将错就错
教学“原电池”一节内容,为了诱发学生的兴趣,我在讲解完原电池的构成原理后,请学生小组讨论原电池的形成条件。学生很顺利地得出三个条件:(1)要有两种活泼性不同的金属或导体。(2)必须有电解质溶液。(3)必须发生氧化还原反应。接下来,我拿出一些水果,让学生试着用它们设计原电池。一向调皮的×××同学把手举得老高,我便请他进行演示。他带着几分得意走上前来,将电极的一边接苹果,另一边接橘子,可是,电流表指针却始终没有发生偏转——原来,他是为了得到老师和同学的注意而上台来“表演”的,却由于对原电池原理的理解不透,闹出了笑话。这时,我对全班说:“×××同学的勇气值得表扬,动手能力也很强,他的电路没能产生电流是由于一个细节问题,谁愿意帮助他一下吗?同桌之间可以交流自己的看法。”学生的回答让我感动:“我觉得他失败的原因是未形成闭合电路,这也是一个容易被其他同学忽略的问题。虽然实验没成功,但他的尝试给我们留下了深刻印象。”然后,全班一起对×××同学的电路进行改进,使“盐桥”(如下图)的出现自然顺应了学生的想法。
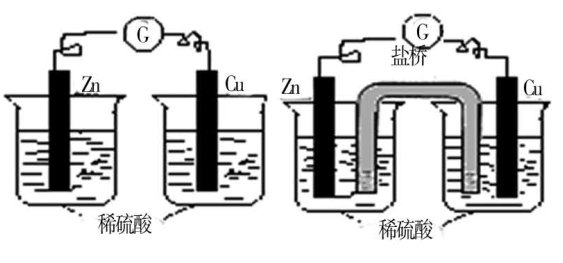
小小的插曲,帮助学生掌握了“原电池设计”的要害。
(三)求真创新
教学“影响化学反应速率的因素”一节内容,为了探究浓度、温度和催化剂对化学反应速率的影响,我创设了这样一个情境:
已知2KMn04+5Hzoz+3HzS04=KzS04+2MnS04 +8Hz0+50z↑。在高锰酸钾酸性溶液和双氧水反应时,发现这样的实验现象:开始一段时间,反应速率较慢,溶液褪色不明显;但不久后溶液突然褪色,反应速率明显加快。
根据影响化学反应速率的因素,学生猜想有两种可能:一是温度的影响(反应放热),二是生成的Mnz+对该反应有催化作用。为了证明猜想,学生分别设计了两个实验:实验一——将两支装有KMn04与H2O2的试管分别浸入冷水和热水中,观察褪色的快慢;实验二——取两支装有KMn04与H2O2的试管,其中一支反应一开始就加入MnS04固体,比较两支试管褪色的快慢。在操作中,一组学生做实验二时将其中一支试管的KM-n04的量加多了,加入MnS04固体后褪色速度没有明显加快,由此得出Mn2+对该反应没有催化作用。我没有马上否定这个错误结论,而是请学生讨论反应所消耗的时间与速率之间的关系。有学生提出:“虽然反应中两支试管反应物的量不同,但由于浓度相同,所以速率相同,因此结论正确。”我借此追问:“速率相同,是否褪色的时间就相同?”学生恍然大悟:“这与反应物的量有关。以相同的速率消耗不等量的反应物,当然反应物的量越多褪色时间就越长。”我再度启发:“在相同量的反应物中加入MnS04溶液好吗?”学生依着刚才讨论的思路,从浓度的角度解释了使用MnS04溶液的弊端。这时,我再次组织学生重新在反应物的量相同的情况下做对比实验。这次的结果与第一次实验相差很大,加入MnS04固体的反应液迅速褪色,充分证明了Mnz+的催化能力。
同样的药品,不一样的结论,一次实验探究就将浓度、温度、催化剂对反应速率的影响全部解决了,学生的脸色都洋溢着收获的满足与喜悦。
课堂是解不开的结,学生是猜不完的谜。动态生成体现了课堂教学的丰富性、开放性、多变性和复杂性,使课堂呈现出旺盛的生命力;学生在动态生成中经历“再创造”,建立属于自己的认知结构,从而真正学有所获、学有所长。

 ★读了本文的人也读了:
★读了本文的人也读了: